
Unidad de Citometría de Flujo
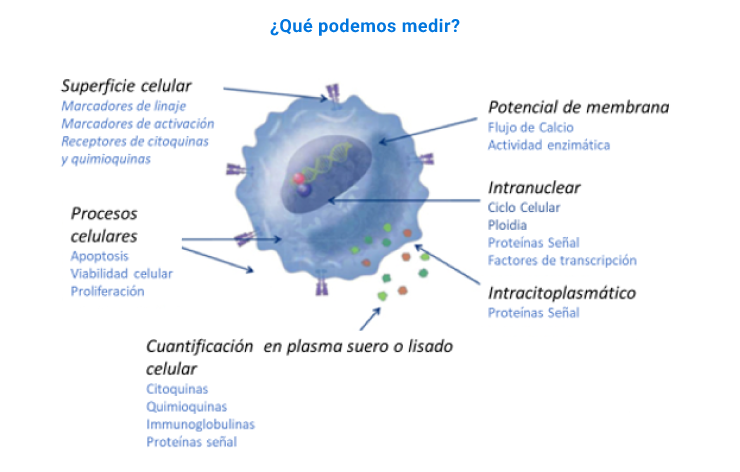
Esta unidad nace por la necesidad de analizar múltiples parámetros en una población celular, siendo capaz de diferenciar desde tipos celulares distintos, detectar diferencias en expresión de proteínas específicas en dichas células.
Además, es posible separar diferentes poblaciones celulares según parámetros específicos determinados por el investigador, lo que permite la purificación de poblaciones que expresan o no una proteína o tienen diferentes características particulares que puedan ser medidas a través de citometría de flujo.

Servicios, Equipos y Recursos
Servicios
Adquisición de Muestras por Citometría de Flujo
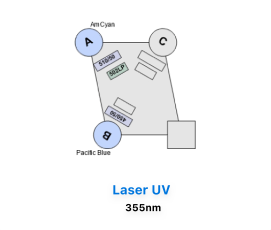
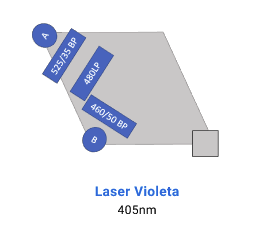
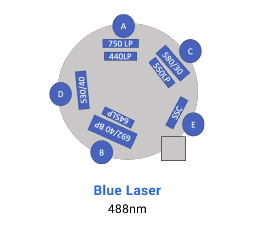
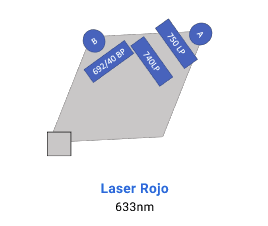
La adquisición de muestras puede realizarse tanto en el FACS Canto II, que está equipado con 3 láseres (violeta de 405 nm, azul de 488 nm y rojo de 633 nm) y tiene capacidad para resolver hasta 10 parámetros. Por otro lado, el BD LSR Fortessa X-20 cuenta con 4 láseres (ultravioleta de 355 nm, violeta de 405 nm, azul de 488 nm y rojo de 633 nm), permitiendo resolver hasta 20 parámetros.

FACS Canto II
- Configuración detectores 2V 4B 28
- 10 parámetros
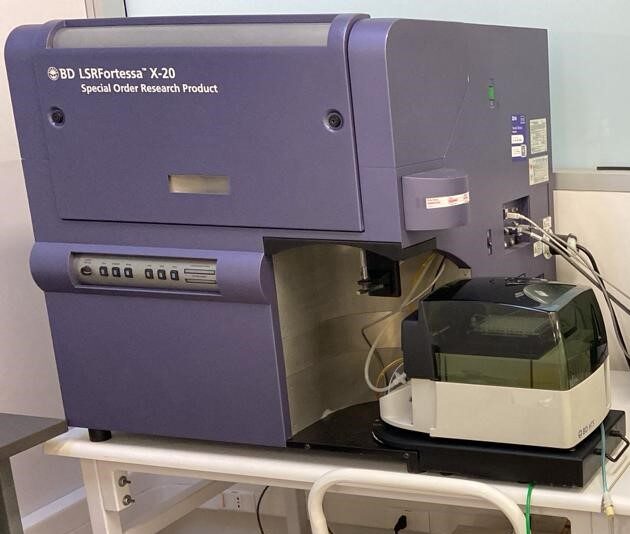
BD LSR Fortessa-X20
- Configuración detectores 2UV 6V 6B 4R
- 20 parámetro
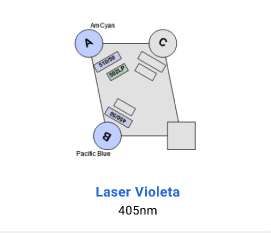
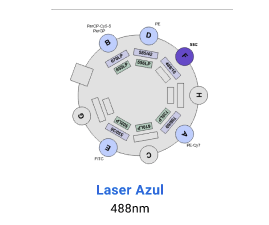
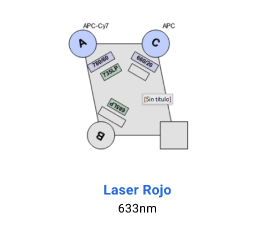
Detectores BD LSR Fortessa X-20
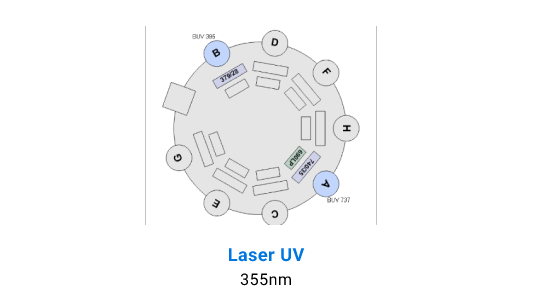
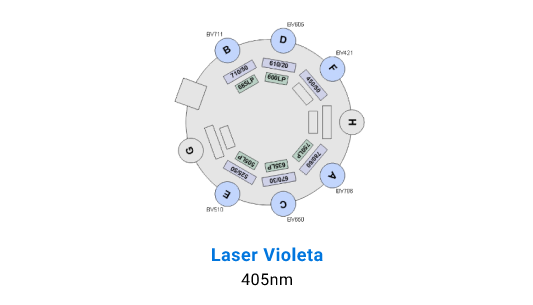
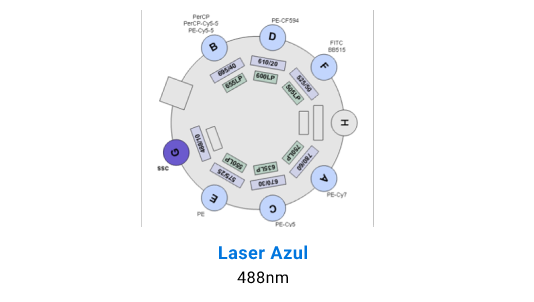
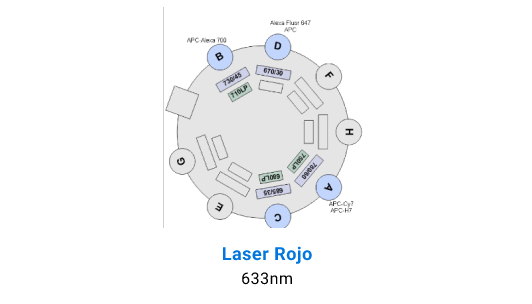
Separación Celular
La separación celular es un proceso complejo que requiere una adecuada coordinación entre el usuario y los operadores del equipamiento. Esto se debe a que cada tipo de célula necesita tratamientos, presiones de trabajo y boquillas (nozzles) que se ajusten adecuadamente a la muestra. Otro factor a tener en cuenta es el tipo de separación a realizar (desde la separación de una sola célula hasta millones de células). Por esta razón, sugerimos a nuestros usuarios concertar una reunión previa (coordinar reunión al email citometria@bio.puc.cl.)
Revise la configuración de nuestros separadores FACS Aria II, que cuenta con 3 láseres (ultravioleta 355 nm, azul 488 nm y rojo 633 nm), capaz de resolver hasta 11 parámetros, o de nuestro BD Influx, que puede resolver hasta 10 parámetros. Además, el separador BD Influx está equipado con la opción “small particle option”, un detector capaz de resolver partículas de hasta 200 nm, siendo de gran utilidad para aplicaciones en biología marina, microbiología y biología ambiental.

FACS Aria II
- Configuración detectores 2UV 5B 2R
- 11 parámetros

BD Influx
- Configuración detectores 2V 4B 2R
- 10 parámetros


Conteo Absoluto
La citometría de flujo permite la cuantificación de diferentes características celulares sin embargo no pueden obtenerse conteos celulares absolutos. Nuestra unidad cuenta con el servicio de conteo celular mediante el uso de “count bright beads ™” sobre volúmenes determinados de células. El uso de estas beads en base a sus características fluorescentes y su número determinado, permite establecer la relación beads-células, otorgando así el número absoluto.
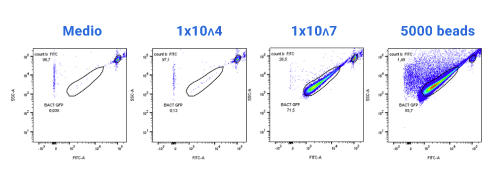
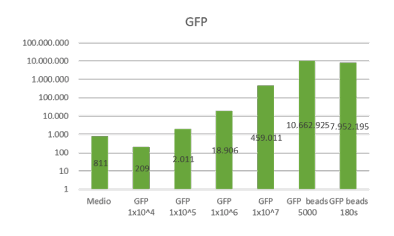
Se consideró realizar recuento absoluto de beads de tinción (Staining beads) que en este caso sirven como células que se desean contar mediante la utilización de beads de recuento absoluto por medio de citometría de flujo. Para esto se consideraron diluciones de las beads de tinción a ½ y ¼ del valor inicial (diluciones: X, ½X y ¼X). Se espera que los recuentos absolutos una vez realizada las mediciones, disminuyan a la mitad del valor inicial y finalmente a la cuarta parte, como sucede a continuación.
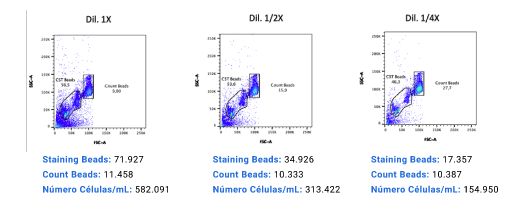
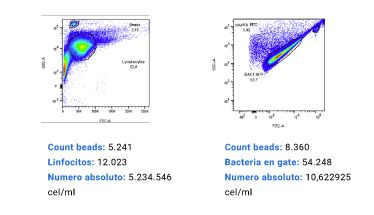
Conclusiones
Como se puede apreciar, el recuento absoluto de beads de tinción en cada caso fue disminuyendo de manera proporcional a la dilución respectiva.
Nota: para el cálculo de numero absoluto de procariontes el límite de detección es de 1×10^6 cel/ml, bajo esa concentración la precisión del método disminuye
Evaluación de contenido de ADN celular o nuclear
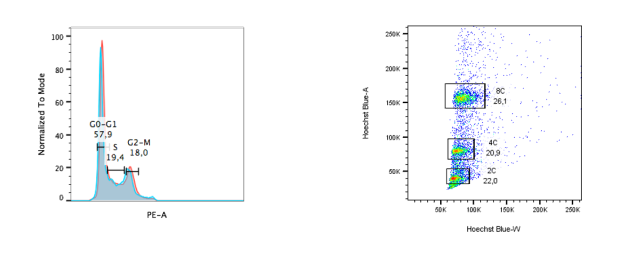
El seguimiento del ciclo celular mediante citometría de flujo es un método rápido y eficiente para estudiar los atributos de poblaciones celulares. Este enfoque se basa en el análisis de variables como el contenido de ADN en cada célula. La utilización de diferentes fluoróforos que se unen de manera cuantitativa al ADN permite medir la intensidad de fluorescencia, lo que facilita la identificación de al menos tres fases principales del ciclo celular. Este análisis es fundamental para estudiar los efectos de fármacos y otros metabolitos sobre el ciclo celular. En cuanto a la selección de cereales con frutos de mayor tamaño, este proceso ha favorecido la aparición de plantas poliploides, que presentan varios beneficios, como un mayor rendimiento por hectárea, esterilidad (ausencia de semillas) y mayor tamaño de los frutos. Estos mismos beneficios derivados de la poliploidía se han observado en algunas especies de peces de agua dulce en las últimas décadas. Durante el siglo pasado, los investigadores han buscado aplicar este conocimiento a especies de peces marinos, de mayor valor económico, mediante la inducción experimental de poliploidía.
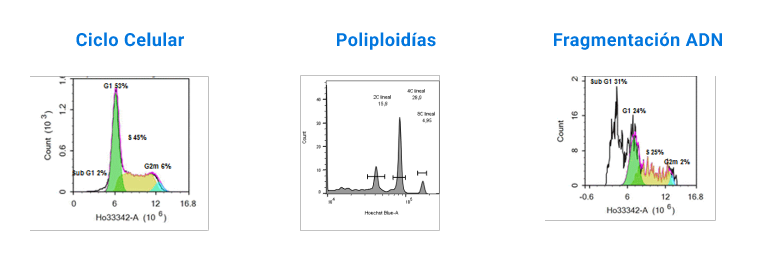
El seguimiento del ciclo celular mediante citometría de flujo es un método rápido y eficiente para estudiar los atributos de poblaciones celulares. Este enfoque se basa en el análisis de variables como el contenido de ADN en cada célula. La utilización de diferentes fluoróforos que se unen de manera cuantitativa al ADN permite medir la intensidad de fluorescencia, lo que facilita la identificación de al menos tres fases principales del ciclo celular.
Este análisis es fundamental para estudiar los efectos de fármacos y otros metabolitos sobre el ciclo celular. En cuanto a la selección de cereales con frutos de mayor tamaño, este proceso ha favorecido la aparición de plantas poliploides, que presentan varios beneficios, como un mayor rendimiento por hectárea, esterilidad (ausencia de semillas) y mayor tamaño de los frutos. Estos mismos beneficios derivados de la poliploidía se han observado en algunas especies de peces de agua dulce en las últimas décadas. Durante el siglo pasado, los investigadores han buscado aplicar este conocimiento a especies de peces marinos, de mayor valor económico, mediante la inducción experimental de poliploidía.
Viabilidad Celular
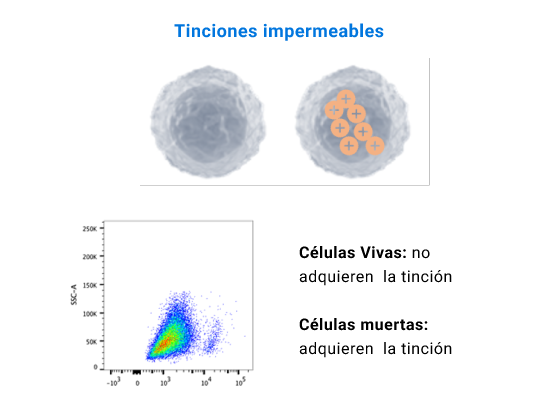
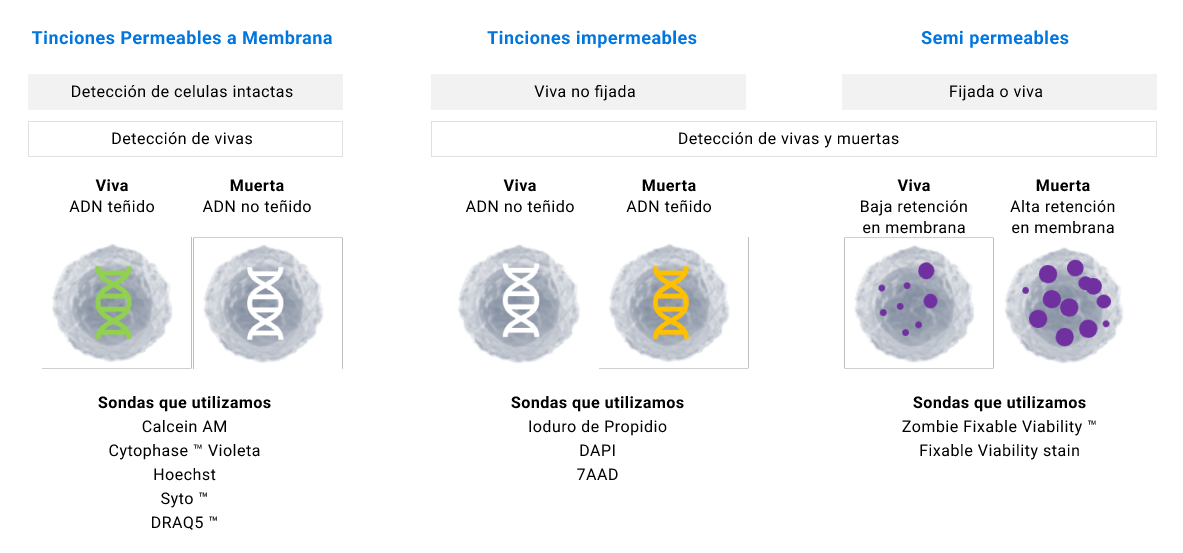
La viabilidad celular es un punto muy importante a tener en cuenta en el desarrollo y análisis experimental. Poder excluir las células muertas dentro del ensayo realizado nos garantiza datos más precisos. Por ello se recomienda en todos los protocolos de tinción en citometría de flujo excluir las células muertas. La idea de excluir las células muertas se debe a que los anticuerpos se unen de manera inespecífica a las células muertas, además se puede aumentar ruido electrónico o uniones inespecíficas que puedan dar lugar a falsos positivos. Existen diversos tipos de sondas que miden la viabilidad celular y que debe ser considerado al momento de utilizarlas.
Taller de análisis personalizado
El análisis de datos obtenidos por citometría de flujo, requiere de un claro entendimiento de fenómenos biológicos. Estos fenómenos deben ser integrados en conjunto con efectos físicos y químicos que influirán en como visualizamos la muestra. No existe un método estandarizado de análisis para todo dato de citometría, ya que dependerá de cada muestra y nuestro objetivo experimental, el cómo debemos analizarla. Por este motivo hemos diseñado talleres de análisis personalizados que se adaptan a los requerimientos de nuestros usuarios.
Los talleres están diseñados para que el o los asistentes puedan tener en aproximadamente 4 horas el conocimiento básico necesario para el correcto análisis de las muestras obtenidas.
Además incluimos ejercicios con muestras problemáticas para que nuestros asistentes puedan ser capaces de reconocer datos adquiridos inapropiadamente o que no pueden ser analizados.



